我国注射剂临床应用广泛、竞争格局复杂、国产替代空间较为有限,而相对口服剂等药品一致性评价进程,注射剂一致性评价进展相对较缓慢。自化药口服制剂一致性评价开展以来,注射剂何时启动一直是关注热点,终于在2020年5月,注射剂一致性评价终于迎来落地。
| 时间 |
内容 |
| 2017年10月 |
两办发布的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》中提出,“根据药品科学进步情况,对已上市药品注射剂进行再评价,力争用5至10年左右时间基本完成”。 |
| 2017年12月 |
CDE发布《已上市化学仿制药(注射剂)一致性评价技术要求(征求意见稿)》。 |
| 2019年4月 |
CDE发布的《化学仿制药参比制剂目录(第二十一批)》中首次出现注射剂剂型,为相关注射剂品种解决了参比制剂这一一致性评价首要难点。 |
| 2019年10月 |
本次在2017年版《技术要求(征求意见稿)》进行了部分改动,还新增了《申报资料要求(征求意见稿)》。目前通过/视同通过一致性评价的注射剂仅10个(且其中8个为按新注册分类获批生产后视同通过),随着文件的细化,预计注射剂相关一致性评价将加速。 |
| 2020年5月 |
注射剂一致性评价正式文件,与去年《征求意见稿》较为一致,整体延续高标准严要求。从具体内容来看,1)评价范围:未按与原研质量和疗效一致性原则审批的已上市品种都要开展;2)参比制剂:根据NMPA发布的《仿制药参比制剂目录》选择;3)豁免品种:临床价值明确但无法确定参比制剂品种,如氯化钠注射液,NMPA将分期分批公布此类目录;4)申请类型:补充申请;5)审评时限:依据NMPA 2018年第102号文,与口服制剂一致。 |
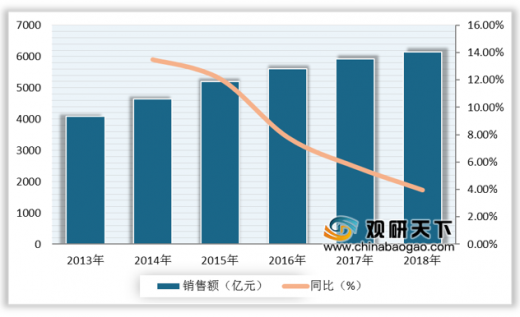
注射剂一致性评价是继仿制药一致性评价之后的又一重磅政策,近年来,国内注射剂市场保持增长态势,2018年我国公立医疗机构终端化药注射剂销售额达6152亿元,同比增长3.94%。
截至2020年5月14日,全国通过注射剂一致性评价的品种(通用名)有41个,在一致性评价审评审批的注射剂品种有136个,其中有33个品种排队厂家数超过或等于3个。注射剂一致性评价正式开启后,过评品种数将快速增加,市场或将迎来终端格局剧变。
| 药品名称 |
通过/视同通过一致性评价企业数量 |
通过企业 |
||
| 注射用紫杉醇(白蛋白结合型) |
3 |
石药欧意 |
江苏恒瑞 |
齐鲁制药 |
| 注射用培美曲塞二钠 |
3 |
四川汇宇 |
上海创诺 |
齐鲁制药 |
| 注射用阿扎胞苷 |
2 |
中国生物制药 |
四川汇宇 |
|
| 左乙拉西坦注射液 |
2 |
济川药业/南京恒道 |
仁合益康 |
|
| 多西他赛注射液 |
1 |
四川汇宇 |
|
|
| 苯磺顺阿曲库铵注射液 |
1 |
南京健友 |
|
|
| 丙泊酚中/长链脂肪乳注射液 |
1 |
广东嘉博 |
|
|
| 布洛芬注射液 |
1 |
成都苑东 |
|
|
| 碘美普尔注射液 |
1 |
博莱科信谊 |
|
|
| 多索茶碱注射液 |
1 |
石家庄四药 |
|
|
| 氟比洛芬酯注射液 |
1 |
武汉大安 |
|
|
| 枸橼酸咖啡因注射液 |
1 |
华润双鹤 |
|
|
| 酮咯酸氨丁三醇注射液 |
1 |
成都倍特 |
|
|
| 盐酸氨溴索注射液 |
1 |
美大康华康 |
|
|
| 盐酸罗哌卡因注射液 |
1 |
石家庄四药 |
|
|
| 盐酸右美托咪定注射液 |
1 |
扬子江 |
|
|
| 依达拉奉氯化钠注射液 |
1 |
中国生物制药 |
|
|
| 依诺肝素钠注射液 |
1 |
常州千红 |
|
|
| 注射用比伐芦定 |
1 |
齐鲁制药 |
|
|
| 注射用替莫唑胺 |
1 |
江苏恒瑞 |
|
|
| 注射用头孢唑林钠/氯化钠注射液 |
1 |
Otsuka |
|
|
| 注射用西维来司他钠 |
1 |
上海汇伦 |
|
|
| 唑来膦酸注射液 |
1 |
四川科伦 |
|
|
| 盐酸阿芬太尼注射剂 |
1 |
人福药业 |
|
|
| 盐酸头孢吡肟氯化钠注射液 |
1 |
苏州大冢制药 |
|
|
| 阿奇霉素注射液 |
1 |
普利制药 |
|
|
| 福沙匹坦双葡甲胺注射剂 |
1 |
翰森制药 |
|
|
| 曲前列尼尔注射剂 |
1 |
李氏大药厂 |
|
|
以上数据资料参考《2020年中国化学药品市场分析报告-行业深度分析与发展前景评估》。
各类行业分析报告查找请登录chinabaogao.com或gyii.cn


【版权提示】观研报告网倡导尊重与保护知识产权。未经许可,任何人不得复制、转载、或以其他方式使用本网站的内容。如发现本站文章存在版权问题,烦请提供版权疑问、身份证明、版权证明、联系方式等发邮件至kf@chinabaogao.com,我们将及时沟通与处理。