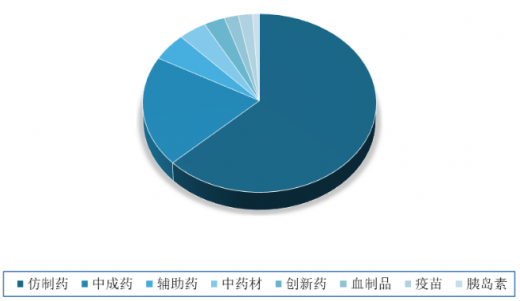
目前我国制药企业中大部分以仿制药为主,药品也是仿制药占主流。数据显示,2018年在国内药品市场上,仿制药占比高达63%。此外,中成药20%,辅助药5%,中药材4%,创新药3%,血制品2%,疫苗2%,胰岛素1%。未来在政策、竞争等多方压力下,中国仿制药企业亟待转型升级,高难度仿制药仍是蓝海领域,仿创结合是必然趋势。
近年来,我国仿制药市场一直在改革,国家不断出台政策一致性评价,这不但提升我国整体仿制药质量,使得我国仿制药正式进入通用名时代,推动国产仿制药实现进口替代。
时间 |
政策名称 |
相关内容 |
2012.01 |
《国家药品安全“十二五”规划》 |
全面提高仿制药质量。对2007年修订的《药品注册管理办法》施行前批准的仿制药,进行质量一致性评价。 |
2013.02 |
关于开展仿制药质量一致性评价工作 |
对2007年修订的《药品注册管理办法》实施前批准的基本药物和临床常用仿制药,分期分批进行质量一致性评价;确定仿制药一致性评价基本原则和工作计划。 |
2016.03 |
关于开展仿制药质量和疗效一致性评价的意见 |
国家基本药物目录(2012年版)中2007年10月1日前批准上市的化学药品仿制药口服固体制剂,应在2018年底前完成一致性评价,其中需开展临床有效性试验和存在特殊情形的品种,应在2021年底前完成一致性评价;逾期未完成的,不予再注册。 |
2016.05 |
总局关于落实《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》 有关事项的公告 |
公布具体落实方案,公布2018年底前须完成仿制药一致性评价品种目录。 |
2017.08 |
总局关于仿制药质量和疗效一致性评价工作有关事项的公告(2017年第 100号) |
主要对一致性评价受理、审评、核查、检验等工作程序进行调整、优化。 |
2017.11 |
289基药目录中可豁免或简化人体生物等效性试验(BE)品种名单 |
公布57个拟豁免或可简化BE试验的品种。 |
2018.12 |
《关于仿制药质量和疗效一致性评价有关事项的公告》政策解读 |
对一致性评价工作的要 求作适当调整和进一步明确。主要对289目录限制进行调整。 |
2019.10 |
《化学药品注射剂仿制药质量和疗效一致性评价技术要求》(征求意见稿) |
开始协定化学药品注射剂仿制药质量和疗效一致性评价技术要求。 |
2019.11 |
《化学药品注射剂仿制药(特殊注射剂)质量和疗效一致性评价技术要求》 (征求意见稿) |
开始协定针对特殊注射剂的仿制药一致性评价。 |
此外,仿制药一致性评价可以很大程度上降低患者的用药费用,还将促进我国药企的优胜劣汰,优化行业竞争格局。(CT)
以上数据资料参考《2020年中国仿制药市场分析报告-市场竞争格局与发展趋势研究》。
各类行业分析报告查找请登录chinabaogao.com 或gyii.cn


【版权提示】观研报告网倡导尊重与保护知识产权。未经许可,任何人不得复制、转载、或以其他方式使用本网站的内容。如发现本站文章存在版权问题,烦请提供版权疑问、身份证明、版权证明、联系方式等发邮件至kf@chinabaogao.com,我们将及时沟通与处理。